Этилендиаминтетрауксусной кислоты динатриевая соль цинка (EDTA-ZnNa2)
CAS No.: 14025-21-9
Молекулярная формула: C10H12N2Na2O8Zn
Молекулярный вес:399.59
Структурная формула:
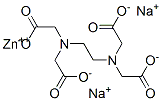
Свойства:
Этилендиаминтетрауксусной кислоты динатриевая соль цинка (EDTA-ZnNa2) используется как микроэлемент в сельском хозяйстве.
Экологические аспекты:
Биоразлагаемость: трудная.
Значение ХПК (химическая потребность в кислороде): 555 мг/г.
Спецификации:
| Пункт | Индекс |
| Внешний вид | Белый порошок |
| Содержание цинка | 15.0±0.5% |
| pH-значение (1% водный раствор) | 6.0±7.0 |
| Растворимость | примерно 1000 г/л (20 ℃), примерно 1200 г/л (80 ℃) |
| Объемная плотность | примерно 625 кг/м3 |
Использование:
Этилендиаминтетрауксусной кислоты динатриевая соль цинка (EDTA-ZnNa2) это стабильный водорастворимый комплексообразующий агент для металлов, при этом цинк находится в хелатированном состоянии. Этилендиаминтетрауксусной кислоты динатриевая соль цинка (EDTA-ZnNa2)используется в качестве агента для разделения. Этилендиаминтетрауксусной кислоты динатриевая соль цинка это стабильный водорастворимый комплексообразующий агент для металлов. EDTA-ZnNa2 может хелатировать многозарядные феррические ионы. Этилендиаминтетрауксусной кислоты динатриевая соль цинка может использоваться для листовых удобрений.
Упаковка и Хранение:
мешок из плетеного материала весом 25 кг. Хранить в прохладном и сухом месте, после вскрытия упаковки необходимо упаковать.
Ключевые слова:
Этилендиаминтетрауксусной кислоты динатриевая соль цинка; EDTA-ZnNa2; EDTA-Zn; Комплексы цинка ЭДТА; ЭДТА.
Вопросы о ЭДТА and Zn2+
.1. Каково число координации Zn2+ при образовании комплекса с ЭДТА?
ЭДТА - аминокарбоновый комплексообразующий агент с шестью координирующими атомами (два аминовых азота и четыре карбоксильных кислорода, обладающих свободной парой электронов). Он может образовывать стабильные 1:1 хелаты с металлическими ионами, которые образуют пятиатомное кольцо. Число координации центрального иона (Zn2+) равно 6. Регулярная октаэдрическая структура.
2. Почему при титровании Zn2+ ЭДТА добавляют NH3-NH4Cl?
NH3-NH4Cl добавляют в качестве буфера для стабилизации рН раствора.
Zn2+ титруют с помощью ЭДТА. Металлический индикатор сначала добавляют в цинковый раствор. Затем цинк реагирует с индикатором, образуя комплекс, и происходит изменение цвета. Металлические индикаторы обычно слабокислотные, имеют высокую чувствительность и явную реакцию цвета. Однако у них также есть определенный диапазон рН. За пределами этого диапазона изменение цвета будет неявным, и комплекс может быть нестабильным, что может привести к ошибке в результатах титрования.
В комплексонометрическом титровании обычно выделяются ионы водорода. Поэтому, по мере продвижения реакции, рН раствора непрерывно изменяется. Это серьезно влияет на развитие цвета индикатора. Поэтому во время титрования необходимо добавить определенное количество буферного раствора для контроля значения рН раствора в определенном диапазоне. Только таким образом можно получить явные экспериментальные явления и точные результаты.
-
EDTA Серия
- EDTA Кислоты
- EDTA-Na2
- EDTA-Na4
- EDTA-CaNa2
- ЧИТАТЬ ДАЛЕЕ...
-
Органофосфорные
- ATMP
- BHMTPMPA
- DTPMPA
- EDTMPA
- PBTCA
- HEDP
- ЧИТАТЬ ДАЛЕЕ...
-
Другие хелатирующие агенты
- DTPA
- NTA.Na3
- DTPA.Na5
- ЧИТАТЬ ДАЛЕЕ...







